Fármaco en fase de investigación
Alrededor del 2 % de las personas afectadas por la ELA tienen una mutación del gen SOD1. Las mutaciones del gen SOD1 pueden provocar la producción de una proteína SOD1 anormal que es probable que sea tóxica para las células y podría ocasionar la muerte de células nerviosas, como se observa en las personas que padecen ELA. Mediante el estudio ATLAS, se analiza si un fármaco en fase de investigación (tofersen) podría retrasar la aparición de los signos o síntomas de la ELA o ralentizar el deterioro de la capacidad funcional una vez que aparecen los signos o síntomas (en comparación con el inicio del tratamiento con tofersen al momento o después de la aparición de la ELA).
El tofersen (BIIB067) es un oligonucleótido antisentido (ASO), que se diseñó para reducir los niveles de la proteína SOD1 en las personas que padecen ELA asociada con una variante del gen SOD1.
Resumen del estudio
El estudio está compuesto por 4 partes, como se describe a continuación.
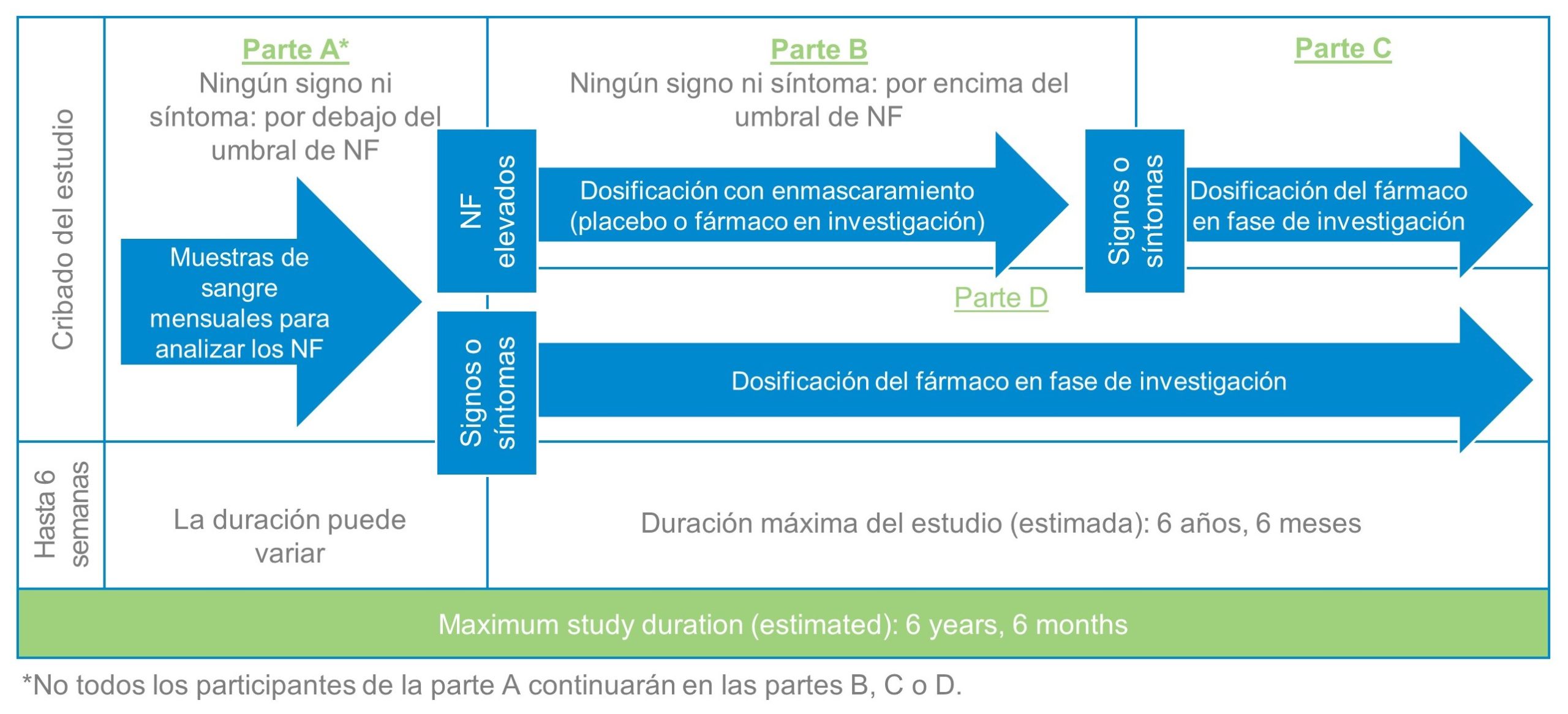
Parte A
Si se detecta una de las variantes genéticas de la SOD1 que se está estudiando y pasa otros exámenes de cribado, califica para ingresar a la parte A del estudio. Durante esta parte, no recibirá ningún tratamiento del estudio, sino que haremos un seguimiento riguroso de su estado de salud y su nivel de neurofilamentos (NF) (en su casa o en el centro del estudio). El equipo del estudio evaluará sus muestras de sangre todos los meses para detectar si el nivel de NF supera el umbral. Se informará a usted y al médico del estudio si el nivel de NF supera el umbral para considerar si reúne los requisitos de la siguiente parte del estudio (parte B). La duración de la parte A puede variar.
Parte B
Si su nivel de NF aumenta por encima del umbral predeterminado durante su participación en la parte A, el médico del estudio evaluará la causa. Si este determina que dicho aumento de NF no se puede atribuir a una otra causa que no esté relacionada con una actividad de la enfermedad ELA, usted puede optar por que se evalúe su idoneidad para participar en la parte B. Durante esta parte del estudio, se determinará la administración del fármaco en fase de investigación o de un placebo. Una computadora asignará esta administración de forma aleatoria, y tendrá las mismas posibilidades de recibir el fármaco en investigación que el placebo. Ni usted ni el equipo del estudio sabrá si recibió el placebo o el fármaco en investigación; este período se denomina doble enmascaramiento.
El fármaco en investigación o el placebo se administran mediante inyección intratecal, lo que significa que se aplican mediante un procedimiento llamado punción lumbar.
Parte C
Si muestra signos o síntomas de ELA durante la parte B del estudio y su médico y un grupo de evaluadores independientes confirman que estos signos o síntomas son una indicación inequívoca de la aparición de ELA, puede elegir someterse a un examen diagnóstico para determinar si puede participar en la parte C del estudio. Durante esta parte, todos recibirán el fármaco en investigación; este período se denomina de extensión abierta. La participación en las partes B y C del estudio tiene una duración total de alrededor de dos años.
Parte D
Si comienza a tener signos o síntomas de ELA durante su participación en la parte A o durante el cribado para ingresar a la parte B, y su médico del estudio y el grupo de evaluadores independientes confirman que estos signos o síntomas son una indicación inequívoca de la aparición de ELA, puede elegir someterse a una prueba de preselección para determinar si puede participar en la parte D del estudio. La parte D consiste en otro período de extensión abierta durante el cual todos recibirán el fármaco en fase de investigación. La participación en la parte D tiene una duración total de alrededor de dos años.
Criterios fundamentales de admisión
Para poder inscribirse en el estudio ATLAS (Parte A), los participantes deben cumplir con los siguientes criterios:
- No tener signos ni síntomas de ELA (que indiquen de forma categórica la aparición de dicha enfermedad)
- Tener una mutación de SOD1 determinada (que esté relacionada con una penetrancia elevada/completa y una progresión rápida de la enfermedad)
- Ser mayor de 18 años
- Tener un nivel de NF en plasma inferior al umbral predefinido
Si califica y elige participar, recibirá lo siguiente sin costo alguno:
- Evaluaciones y valoraciones de salud exhaustivas relacionadas con el estudio, incluidas pruebas genéticas
- El fármaco en fase de investigación o el placebo
- Todas las consultas y atención relacionadas con el estudio
Apoyo para traslados
Es posible que también pueda acceder a apoyo para traslados y alojamiento y el reembolso de gastos relacionados con el estudio.




